Beberapa faktor
yang mempengaruhi kecepatan reaksi antara lain konsentrasi, sifat zat yang
bereaksi, suhu dan katalisator.
Konsentrasi
Dari berbagai
percobaan menunjukkan bahwa makin besar konsentrasi zat-zat yang bereaksi makin
cepat reaksinya berlangsung. Makin besar konsentrasi makin banyak zat-zat yang
bereaksi sehingga makin besar kemungkinan terjadinya tumbukan dengan demikian
makin besar pula kemungkinan terjadinya reaksi.
Sifat zat yang bereaksi
Sifat zat yang
mudah atau sukar bereaksi akan menentukan kecepatan berlangsungnya suatu
reaksi. Secara umum dinyatakan bahwa: ”Reaksi antara senyawa ion umumnya
berlangsung cepat.” Hal ini disebabkan oleh adanya gaya tarik menarik
antara ion-ion yang muatannya berlawanan.
Contoh: Ca2+(aq)
+ CO32+(aq) → CaCO3(s)
Reaksi ini
berlangsung dengan cepat. Reaksi antara senyawa kovalen umumnya
berlangsung lambat. Hal ini disebabkan oleh reaksi yang berlangsung tersebut
membutuhkan energi untuk memutuskan ikatan-ikatan kovalen yang terdapat dalam
molekul zat yang bereaksi.
Contoh:
CH4(g) + Cl2(g)
-> CH3Cl(g) + HCL(g)
Reaksi ini berjalan lambat
reaksinya dapat dipercepat apabila diberi energi, misalnya; cahaya matahari.
Suhu
Pada umumnya
reaksi akan berlangsung lebih cepat bila suhu dinaikkan. Dengan menaikkan suhu
maka energi kinetik molekul-molekul zat yang bereaksi akan bertambah sehingga
akan lebih banyak molekul yang memiliki energi sama atau lebih besar dari Ea.
Dengan demikian lebih banyak molekul yang dapat mencapai keadaan transisi atau
dengan kata lain kecepatan reaksi menjadi lebih besar. Secara matematis
hubungan antara nilai tetapan laju reaksi (k) terhadap suhu dinyatakan
oleh formulasi ARRHENIUS:
dimana:
k : tetapan laju reaksi
A : tetapan Arrhenius yang harganya
khas untuk setiap reaksi
Ea : energi pengaktifan
R : tetapan gas universal =
0,0821.atm/moloK atau 8,314 Joule/moloK
T : suhu reaksi (oK)
Setiap suhu naik 100 C,
laju reaksi menjadi dua kali lipatnya.
∆t = kenaikan suhu
Contoh : Suatu reaksi berlangsung
selama 2 jam pada suhu 250C. Berapa kalikah laju reaksi akan
meningkat jika suhu diubah menjadi 450C ?
Penyelesaian :
Kenaikan suhu (∆t) = 45 – 25 = 200C
→ Laju reaksi menjadi 4X atau lama
reaksi menjadi 2/4 jam.
Laju reaksi meningkat, reaksi akan
semakin cepat berlangsung).
KATALISATOR
Katalisator
adalah zat yang ditambahkan ke dalam suatu reaksi yang mempunyai tujuan
memperbesar kecepatan reaksi. Katalis terkadang ikut terlibat dalam reaksi
tetapi tidak mengalami perubahan kimiawi yang permanen, dengan kata lain pada
akhir reaksi katalis akan dijumpai kembali dalam bentuk dan jumlah yang sama
seperti sebelum reaksi.
Fungsi katalis
adalah memperbesar kecepatan reaksinya (mempercepat reaksi) dengan jalan
memperkecil energi pengaktifan suatu reaksi dan dibentuknya tahap-tahap reaksi
yang baru. Dengan menurunnya energi pengaktifan maka pada suhu yang sama reaksi
dapat berlangsung lebih cepat.
Halaman ini
menitikberatkan pada perbedaan tipe-tipe katalis (heterogen dan homogen)
beserta dengan contoh-contoh dari tiap tipe, dan penjelasan bagaimana mereka
bekerja. Anda juga akan mendapatkan deskripsi dari satu contoh
autokatalis reaksi dimana hasil produk juga turut mengkatalis.
Tipe-tipe dari reaksi
katalis
Katalis dapat
dibagi berdasarkan dua tipe dasar, yaitu heteregon dan homogen. Didalam reaksi
heterogen, katalis berada dalam fase yang berbeda dengan reaktan. Dalam reaksi
homogen, katalis berada dalam fase yang sama dengan reaktan.
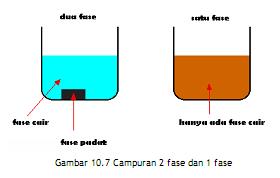
Apa itu fase?
Jika kita
melihat suatu campuran dan dapat melihat suatu batas antara dua komponen, dua
komponen itu berada dalam fase yang berbeda. Campuran antara padat dan cair
terdiri dari dua fase. Campuran antara beberapa senyawa kimia dalam satu
larutan terdiri hanya dari satu fase, karena kita tidak dapat melihat batas
antara senyawa-senyawa kimia tersebut.
Kita mungkin
bertanya mengapa fase berbeda dengan istilah keadaan fisik (padat, cair
dan gas). Fase juga meliputi padat, cair dan gas, tetapi lebih sedikit luas.
Fase juga dapat diterapkan dalam dua zat cair (sebagai contoh, minyak dan air)
dimana keduanya tidak saling melarutkan. Kita dapat melihat batas diantara
kedua zat cair tersebut.
Jika Anda lebih
cermat, sebenarnya diagram diatas menggambarkan lebih dari fase yang diterakan.
Masing-masing, sebagai contoh, beaker kaca merupakan fase zat padat. Sebagian
besar gas yang berada diatas zat cair juga merupakan salah satu fase lainnya.
Kita tidak perlu memperhitungkan fase-fase tambahan ini karena mereka tidak
mengambil bagian dalam proses reaksi.
Katalis Homogen
Bagian ini
meliputi penggunaan katalis dalam fase berbeda dari reaktan. Contoh-contoh
meliputi katalis padat dengan reaktan-reaktan dalam fase cair maupun gas















0 komentar:
Posting Komentar